الهيدروكربونات مركبات كيميائية تُشكّل العمود الفقري للمواد العضوية حولنا، من وقود السيارات إلى البلاستيك وحتى العطور! تتكون هذه المركبات من عنصرين فقط هما الكربون والهيدروجين، لكن اختلاف طبيعة الروابط بين ذراتها يُنتج أنواعًا متعددة بخصائص فريدة.
في هذه المقالة، سنستكشف معًا أنواع الهيدروكربونات الرئيسية:
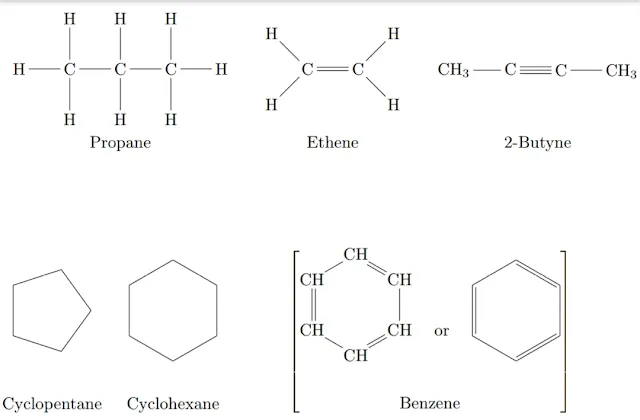
- الهيدروكربونات المشبعة (مثل الميثان والبروبان) — حيث تكون جميع الروابط أحادية ومُشبعة بالهيدروجين.
- الهيدروكربونات غير المشبعة (مثل الإيثيلين والأسيتيلين) — التي تحتوي على روابط ثنائية أو ثلاثية تُكسبها تفاعلية عالية.
- الهيدروكربونات الأروماتية (مثل البنزين) — حلقات كربونية مستقرة بتركيب مميز.
سنتعمق في كل نوع عبر شرح هياكله الكيميائية، خصائصه، وتطبيقاته العملية في حياتنا اليومية.
ما هي الهيدروكربونات؟
الهيدروكربونات هي الفئة الرئيسية من المركبات العضوية والتي تشتق منها غالبا باقي المركبات الكيميائية العضوية. وهي تتكون من الكربون والهيدروجين فقط وترتبط كيميائيا بروابط تساهمية. وهي المكونات الأساسية للنفط الخام، والغاز الطبيعي.
أنواع الهيدروكربونات
الهيدروكربونات المشبعة
الهيدروكربونات المشبعة أو البرافينات (الاسم الشائع) هي المركبات العضوية التي تتكون من الكربون والهيدروجين بروابط تساهمية مفردة وتسمى نظاميا ب "الألكانات". ولها الصيغة العامة CnH2n+2، حيث n عدد ذرات الكربون. الميزة الأساسية في هذه المركبات هي الروابط التساهمية المفردة، وهي من نوع سجما، \(\sigma\). وكل كربون داخل جزيء الهيدروكربون المشبع يجب أن يرتبط برابطة أحادية مع ذرات الكربون الأخرى داخل هذا الجزيء.
تأثر الطبيعية التساهمية للرابطة على التفاعلات الكيميائية للألكانات، والخصائص الفيزيائية؛ مثل نقاط الانصهار والغليان. وبسبب عدم وجود فرق في السالبية الكهربية بين ذرات الكربون، والفرق القليل جدا بينها وبين كهرسلبية الهيدروجين؛ فإن الرابطة غير قطبية، ما يجعل هذه المركبات لا تذوب في المذيبات القطبية. وهذه المركبات غير تفاعلية، وتستجيب لعدد قليل من التفاعلات الكيميائية مثل الاحتراق والاستبدال في ظروف معينة.
تشمل أهم الهيدروكربونات المشبعة: مكونات الغاز الطبيعي؛ الميثان (\(\ce{CH4}\))، الايثان (\(\ce{C2H6}\))، البروبان (\(\ce{C3H8}\)). اقرأ المقالة الكاملة عن تسمية الألكانات.
تقسم الهيدروكربونات المشبعة إلى:
الهيدروكربونات المشبعة الأليفاتية المستقيمة:
وهي تتكون من سلسلة مستقيمة (مستمرة) من ذرات الكربون. أبسط مركب الكاني اليفاتي هو الميثان؛ وهو يتكون من ذرة كربون واحدة وأربعة ذرات هيدروجين. أما باقي الهيدروكربونات الأليفاتية المشبعة تمتلك في الأطراف ذرتي كربون مرتبطة بثلاث ذرات هيدروجين، وذرات الكربون في الوسط أن وجدت فهي ترتبط بذرتي هيدروجين.

الهيدروكربونات المشبعة الأليفاتية المتفرعة:
هي تشبه النوع السابق ولكن في هذا النوع يتم استبدال أحد ذرات الهيدروجين في السلسلة المفتوحة بمجموعة ألكيلية (\(\ce{CH3-}\) أو \(\ce{C2H5-}\) وغيرها).

الهيدروكربونات الحلقية المشبعة:
في هذه المركبات تكون أطراف الجزيء متصلة ببعضها في شكل حلقة(دائرة). ويحصل ذلك بانتزاع ذرة هيدروجين من كل طرف لترتبط الأطراف فيما بينها. لتصبح الصيغة العامة لها: CnH2n. يمكن أن تكون الحلقة مثلثة إذا احتوت على ثلاثة ذرات كربون، أو رباعية إذا احتوت أربعة ذرات كربون، أو سداسية بست ذرات كربون وهكذا.

الهيدروكربونات غير المشبعة
يتم تقسيم الهيدروكربونات غير المشبعة إلى:
الأوليفينات:
الأوليفينات (الألكينات) هيدروكربونات غير مشبعة تحتوي على رابطة مزدوجة بين ذرات الكربون. الصيغة العامة للألكينات هي: CnH2n، فهي نفس صيغة الألكانات الحلقية لأن كلتاهما تكونت من انتزاع ذرتي هيدروجين من جزيء الألكان. يمكن أن تحتوي على رابطة مزدوجة واحدة أو أكثر. وهذه الروابط تساهمية غير قطبية؛ إحداهما من النوع سجما(\(\sigma\)) والآخر من النوع باي(\(\pi\)).
الرابطة باي هي موضع الاختلاف عن الألكانات. وتعد هذه الرابطة أضعف من الرابطة سجما، لذلك فإن الألكينات أكثر تفاعلية من الألكانات لسهولة كسر الرابطة باي. يمكن إضافة جزيء هيدروجين إلى الرابطة باي لتتحول الالكين إلى ألكان. الأمر الذي يجعل تفاعلات الإضافة للألكينات هي الأشهر في هذه الفئة.
من أمثلة الألكينات؛ الايثين (\(\ce{CH2=CH2}\): هو أبسط مثال للألكينات)، البروبين (\(\ce{CH3CH=CH2}\)).
تعرف على المقالة الكاملة عن تسمية الألكينات.
يجب ملاحظة أن الكربون المشارك في الرابطة المزدوجة تربط بذرتي هيدروجين إن كان في الطرف، وبذرة هيدروجين وحدة إن كان في الوسط، وإذا حوصر بين رابطتين مزدوجتين فلا تكون هناك فرصة للارتباط بالهيدروجين. أي مثل: \(\ce{=C=}\). لأن روابط الكربون الأربعة كلها مشغولة.
الأسيتيلينات:
الأسيتيلينات (الألكاينات) هي أيضا هيدروكربونات غير مشبعة ولكنها تحتوي على روابط ثلاثية بين ذرات الكربون، على الأقل رابطة ثلاثية واحدة. وهذه يعني أن الصيغة العامة لها: CnH2n-2. وهذه الروابط عبارة عن رابطة واحدة من النوع سجما، ورابطتين من النوع باي. فهي أيضا تقبل تفاعلات الإضافة لتتحول إلى الألكينات ومع المزيد من الهدرجة(إضافة الهيدروجين) تتحول إلى ألكانات. لمنع التحول إلى الألكانات يمكن استخدام الهدرجة الانتقائية باستخدام محفز ليندلار.
بعض أمثلة الهيدروكربونات غير المشبعة ذات الروابط الثلاثية: البروباين (\(\ce{CH3-C#CH}\))، 2-بيوتاين (\(\ce{CH3-C#C-CH3}\)).
والجدول التالي يوضح تصنيف الهيدروكربونات الأليفاتية مع الأسماء النظامية والشائعة بالإضافة إلى الصيغة العامة لكل منها:
الهيدروكربونات الأروماتية
الهيدروكربونات الأروماتية (العطرية) عبارة هيدروكربونات حلقية تحتوي على روابط مزدوجة متبادلة مع الروابط المفردة (-=-=-=). يطلق لفظ "أروماتي" أو "عطري" على أية حلقة هيدروكربونية تتبع هذه الشروط. يمكن ملاحظة أن هذه المركبات عبارة عن ألكينات لها صفة خاصة، وهي وجود الروابط المزدوجة على شكل تبادلي مع المفردة داخل الحلقة.

- البنزين (Benzene): أبسط مركب عطري، يتكون من حلقة سداسية من ذرات الكربون مع روابط مزدوجة متناوبة.
- التولوين (Toluene): مشتق من البنزين، حيث تستبدل ذرة هيدروجين في حلقة البنزين بمجموعة ميثيل (Methyl group).
- النفثالين (Naphthalene): هيدروكربون عطري متعدد الحلقات، يتكون من حلقتي بنزين مندمجتين معاً.
في داخل الحلقة تتبادل الروابط المفردة والمزدوجة أماكنها باستمرار وكأنه تفاعل اتزان عكسي، وهذا الاتزان بالإضافة إلى الشكل الهندسي للحلقة يعطيان استقرار أكثر للمركب الأروماتي، ويسمى هذا الاستقرار ب "الاستقرار الرنيني". وهذا يجعل الحلقات أقل تفاعلية. فهي تتفاعل بشكل أكبر عن طريق المجموعة البديلة. يمكن كسر الحلقة باستخدام ظروف معينة مثل المحفزات أو درجات الحرارة المرتفعة والضغوط العالية.
ومن أكثر أمثلة الهيدروكربونات العطرية شهرة جزيء "البنزين" وهو ليس المصطلح المشهور في الشارع الذي يطلق على وقود السيارات[1]. يتركب البنزين من ست ذرات كربون وست ذرات هيدروجين في حلقة سداسية وتكون ذرات الكربون مرتبطة بروابط مفردة ومزدوجة بالتناوب كما ذكرنا. وما دام أن عدد ذرات الكربون والهيدروجين متساوية الهيدروكربونات العطرية يمكننا كتابة الصيغة العامة كالتالي: CnHn. وعند وجود مجموعة بديلة تصبح الصيغة العامة للحلقة: (CnHn-1)-.
أصول المصطلحات: البارافينات، الأوليفينات، الأسيتيلينات، والأروماتيات ومدلولاتها
البارافينات (Paraffins): يُطلق على الهيدروكربونات المشبعة، والتي تشمل الألكانات (Alkanes) ذات الروابط الأحادية فقط، هذا الاسم الشائع. وهو مشتق من الكلمة اللاتينية "parum affinis"، والتي تعني "قليل الألفة" أو "قليل النشاط الكيميائي". يعكس هذا المدلول الاستقرار الكيميائي النسبي للألكانات وقلة تفاعليتها بسبب الروابط الأحادية القوية والمستقرة بين ذرات الكربون.
الأوليفينات (Olefins): هذا هو الاسم الشائع للهيدروكربونات غير المشبعة التي تحتوي على روابط مزدوجة (Double Bonds)، وتعرف نظامياً بالألكينات (Alkenes). الكلمة مشتقة من اللاتينية "oleum" (زيت) و "faciens" (صانع)، أي "صانع الزيت". تعود هذه التسمية إلى الملاحظة التاريخية بأن أول الألكينات المكتشفة كانت تتفاعل مع الهالوجينات لتكوين سوائل زيتية.
الأسيتيلينات (Acetylenes): يُعرف هذا المصطلح بشكل شائع للإشارة إلى الهيدروكربونات غير المشبعة التي تحتوي على روابط ثلاثية (Triple Bonds)، والتي تُسمى نظامياً الألكاينات (Alkynes). التسمية مشتقة من غاز الأسيتيلين (Acetylene)، وهو أبسط مركب في هذه الفئة (الإيثاين - Ethyne). نظراً لأهميته واستخدامه الصناعي المبكر، أصبح اسمه يمثل الفئة بأكملها.
الأروماتيات (Aromatics): تُسمى الهيدروكربونات العطرية بهذا الاسم الشائع. وهو مشتق من الكلمة اليونانية "aroma" (رائحة عطرية). تاريخياً، العديد من المركبات الأولى المكتشفة التي تحتوي على حلقة البنزين (Benzene Ring) كانت تتميز بروائح عطرية مميزة، مما أدى إلى هذه التسمية. على الرغم من أن بعض المركبات العطرية الحديثة قد لا تمتلك رائحة، إلا أن الاسم بقي للدلالة على هذه الفئة الفريدة من المركبات التي تتمتع باستقرار خاص ناتج عن ظاهرة الرنين (Resonance) في حلقاتها.
الفرق بين أنواع الهيدروكربونات
نستنتج مما سبق أن هناك فروقات في البنية الجزيئية للهيدروكربونات والتي تتمثل في كيفية الترابط بين ذرات الكربون. هذه الاختلافات أثرت على تفاعلية الهيدروكربونات وخصائصها الفيزيائية. الجدول التالي عبارة عن ملخص عن الفرق بين أنواع الهيدروكربونات المختلفة وتأثيره في خصائص الهيدروكربونات.
| النوع (Type) | مثال (Example) | نوع الروابط (Bond Type) | الخصائص الكيميائية (Chemical Properties) |
|---|---|---|---|
|
هيدروكربونات مشبعة (Saturated Hydrocarbons)
(الألكانات - Alkanes) |
إيثان (Ethane): $\ce{CH3-CH3}$ | روابط تساهمية أحادية (Single Covalent Bonds) من نوع سيجما ($\sigma$) فقط بين ذرات الكربون. |
|
| هيدروكربونات غير مشبعة (Unsaturated Hydrocarbons) |
|
تحتوي على رابطة تساهمية واحدة على الأقل متعددة (Multiple Bond) بين ذرات الكربون (مزدوجة أو ثلاثية). تتكون هذه الروابط من نوعي سيجما ($\sigma$) وباي ($\pi$). |
|
|
هيدروكربونات عطرية (Aromatic Hydrocarbons)
(الأروماتيات - Aromatics) |
بنزين (Benzene): حلقة سداسية ($\ce{C6H6}$) | نظام من الروابط الأحادية والمزدوجة المتناوبة (Alternating Single and Double Bonds) داخل حلقة مستوية ومغلقة، وتكون الإلكترونات غير متمركزة (Delocalized Electrons). |
|
خاتمة
في ختام هذا المقال، يمكن القول أن الهيدروكربونات هي مركبات عضوية تتكون من الكربون والهيدروجين فقط. تُصنف الهيدروكربونات إلى أنواع مختلفة بناءً على بنية جزيئاتها. تتميز أنواع الهيدروكربونات المختلفة بخصائص فيزيائية وكيميائية مختلفة.
تُستخدم الهيدروكربونات في العديد من التطبيقات الصناعية والتجارية. على سبيل المثال، تُستخدم الهيدروكربونات البترولية في إنتاج الوقود والبلاستيك والمذيبات. تُستخدم الهيدروكربونات العطرية في صناعة العطور والمستحضرات الصيدلانية.
تُعد الهيدروكربونات مركبات مهمة لها العديد من التطبيقات العملية. من خلال فهم خصائص الهيدروكربونات المختلفة، يمكننا استخدامها بشكل أكثر كفاءة وفعالية.
الأسئلة الشائعة
ما المقصود بالهيدروكربونات المشبعة؟
يقصد بذلك، أنها مشبعة بذرات الهيدروجين، ولا تقبل الإضافة.
أيهما أكثر تفاعلية ولماذا؟ الهيدروكربونات المشبعة أم غير المشبعة!
الهيدروكربونات غير المشبعة أكثر تفاعلية. لأنها تحتوي على رابطة باي ضعيفة تنكسر بسهولة عن طريق تفاعلات الإضافة.
لماذا الهيدروكربونات الأروماتية أكثر استقرارا؟
بسبب صفة الرنين الذي ينتج عن تبادل المواقع بين الروابط المفردة والمزدوجة داخل الجزيء.
لماذا لا تذوب الهيدروكربونات في المذيبات القطبية؟
قيمة الفرق في الكهروسلبية بين ذرات الهيدروكربونات أقل من 0.4، وهذا يجعلها جزيئات غير قطبية. لذلك لا تذوب في المذيبات القطبية مثل الماء.


