سنتعرف في هذا المنشور على تصنيف وتسمية الكحولات، وتشمل طرق التسمية النظامية والشائعة مع أمثلة مختلفة. لكن قبل ذلك دعونا نعرف الكحولات أولا.
ما هي الكحولات؟
الكحولات أو الغولات هي عبارة عن مركبات عضوية تدخل في بنيتها الجزيئية مجموعة الهيدروكسيل (-OH).
ما هي الصيغة الكيميائية للكحولات؟
- تعتمد تسمية وتصنيف الكحولات على بنيتها الكيميائية.
- يمكن اعتبارها مشتقات للهيدروكربونات (\(\ce{R-H}\))، حيث يتم استبدال ذرة هيدروجين بوحدة \(\ce{OH-}\)[1]، مما يجعل صيغتها \(\ce{R-OH}\)، حيث \(\ce{R}\) تمثل مجموعة ألكيلية[2].
- كما يمكن النظر إلى الكحولات على أنها مشتقات للماء (\(\ce{H-OH}\))، حيث استبدلت إحدى ذرتي الهيدروجين بمجموعة ألكيلية (\(\ce{R}\))، لتصبح صيغتها \(\ce{R-OH}\).
- بناءً على ما سبق، وباعتبار \(\ce{R} = \ce{C_{n}H_{2n + 1}}\) تصبح الصيغة العامة: \(\ce{C_{n}H_{2n + 1}-OH}\). حيث \(\text{n}\) هو عدد ذرات الكربون.

تصنيف الكحولات
يتم تصنيف الكحولات تبعا لعاملين وهي:
أ. تصنيف الكحولات تبعا لنوع ذرة الكربون التي تحمل المجموعة OH
تُصنف الكحولات إلى ثلاثة أنواع رئيسية بناءً على عدد ذرات الكربون المرتبطة بذرة الكربون الحاملة لمجموعة الهيدروكسيل (-OH):
الكحولات الأولية 1°:
يعتبر الكحول أولي، عندما تكون ذرة الكربون الحاملة لمجموعة الهيدروكسيل مرتبطة بذرة كربون واحدة فقط، وذرتي هيدروجين، ومجموعة الهيدروكسيل نفسها.
يتم اعتبار الميثانول على أنه كحول أولي في المراجع الكيميائية بالرغم من ارتباط ذرة الكربون المتصل بالمجموعة الوظيفية بثلاث ذرات هيدروجين. ما عدا ذلك فإن الصيغة العامة لباقي الغولات الأولية هي: \(\ce{RCH2OH}\) [3].

أمثلة على الكحولات الأولية:

الكحولات الثانوية 2°:
هي عبارة عن مركبات تكون فيها ذرة الكربون الحاملة لمجموعة الهيدروكسيل مرتبطة بذرتي كربون أخريين، وذرة هيدروجين واحدة [4]. وتكون صيغتها، \(\ce{R2CHOH}\)، حيث توجد مجموعتي ألكيل بديلة.

أمثلة على الكحولات الثانوية: 2-بروبانول، 2-بنتانول، 3-بنتانول.

الكحولات الثالثية 3°:
في الكحولات الثالثية يتم ارتباط ذرة الكربون الحاملة لمجموعة الهيدروكسيل بثلاث مجموعات ألكيلية. وتأخذ الصيغة، \(\ce{R3COH}\). ونلاحظ عدم ارتباط الكربون المتصل بالزمرة الوظيفية بأي ذرة هيدروجين.
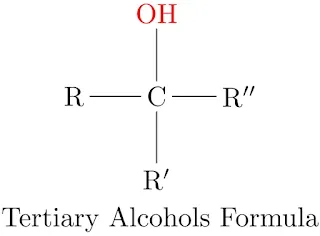
أمثلة على الكحولات الثالثية: الصورة أدناه تحتوي على أشكال مختلفة للكحولات الثالثية.

ب. تصنيف الكحولات حسب عدد مجموعات الهيدروكسيل
يُصنّف الكحول بناءً على عدد مجموعات الهيدروكسيل (–OH) المرتبطة بالسلسلة الهيدروكربونية إلى أنواع متعددة، أهمها:
1. الكحولات أحادية الهيدروكسيل:
هي الكحولات التي تحتوي على مجموعة هيدروكسيل واحدة فقط مرتبطة بسلسلة هيدروكربونية. وتمثلها الصيغة العامة: $\ce{R-OH}$. وتندرج جميع الأمثلة المذكورة أعلاه ضمن هذا النوع[3].
2. الكحولات ثنائية الهيدروكسيل (الديولات):
تحتوي على مجموعتين من –OH في الجزيء الواحد، وتُعرف أيضًا بالديولات. وصيغتها العامة: $\ce{R(OH)2}$[5].
3. الكحولات ثلاثية الهيدروكسيل (الترايولات):
تحتوي على ثلاث مجموعات هيدروكسيل، مثل مركب الجليسرول، وتُسمى بالترايولات أو الكحولات الثلاثية. وتمثلها الصيغة العامة: $\ce{R(OH)3}$[5].
4. الكحولات عديدة الهيدروكسيل (البوليولات):
وهي كحولات تحتوي على أكثر من مجموعة هيدروكسيل، وتُعرف باسم بوليولات (Polyols)[6]. يشمل هذا التصنيف الكحولات الثنائية والثلاثية وما زاد عليها، وتُعطى الصيغة العامة: $\ce{R(OH)_n}$ حيث $n \geq 2$.
اقرأ أيضًا: طرق تحضير الكحولات
تسمية الكحولات
يتم تسمية الكحولات بنظام IUPAC غالبا، ولكن هناك أيضا التسمية الشائعة، وطريقة الكربونيل وهي أقل شيوعا من سابقاتها.
قواعد تسمية الكحولات النظامية (IUPAC)
يتم تسمية الكحولات كمشتقات للألكان الأم باستخدام اللاحقة (-ول (-ol))، وذلك وفقًا لقواعد IUPAC الأساسية لتسمية المركبات العضوية (كما ورد في منشور قواعد تسمية الألكانات) بالإضافة إلى القواعد الخاصة بالكحولات التالية:
-
- تحديد السلسلة الأم وتغيير اللاحقة:
-
يجب تحديد أطول سلسلة كربونية متصلة والتي تحتوي على مجموعة الهيدروكسيل (-OH). تعتبر هذه السلسلة هي الألكان الأم لاشتقاق الاسم منه، وتُستبدل النهاية (ـان) في اسم الألكان باللاحقة (ـول) لتصبح ألكانول. على سبيل المثال، بروبانول بدلاً من بروبان، وميثانول بدلاً من ميثان.
ملاحظة: بالإنجليزية يتم حذف حرف (e) في نهاية كلمة alkane وتضاف (ol) (مثال: methanol من methane). أما إذا توسط رقم أو حرف آخر بين الألكان و"ول" (مثل في diol)، فيتم الإبقاء على حرف (e) والذي نعتبره (ي) في العربية، كما في cis 1,4-cyclohexanediol، ونكتبه بالعربية (سيس ١،٤-سيكلوهكسانيديول).
-
- أولوية ترقيم مجموعة الهيدروكسيل:
- يتم ترقيم سلسلة الألكان الأم بدءًا من النهاية الأقرب لمجموعة الهيدروكسيل. يجب أن تحصل ذرة الكربون الحاملة لمجموعة الهيدروكسيل على أقل رقم ممكن. هذا المبدأ له أولوية على ترقيم الفروع الأخرى. في حالة ترقيم الكحولات الحلقية، تُعطى ذرة الكربون الحاملة لمجموعة الهيدروكسيل رقم 1.
-
- تحديد وتسمية البدائل (التفرعات):
- تُحدد جميع البدائل (التفرعات) الأخرى على السلسلة الأم وتُكتب أرقام مواقعها وأسمائها. يتم اتباع نفس القواعد العامة لترتيب التفرعات الأبجدي واستخدام البادئات العددية كما هو موضح في قواعد تسمية الألكانات.
تطبيق قواعد الترقيم في السلاسل الخطية (القاعدة الثانية):
يتم ترقيم أطول سلسلة كربونية تحتوي على مجموعة الهيدروكسيل بدءاً من الطرف الأقرب لهذه المجموعة. توضح الصورة أدناه أمثلة تطبيقية لكيفية تحديد الطرف الأقرب والترقيم بناءً عليه في سلاسل مختلفة الأطوال:
في المثال العلوي في الصورة، لدينا سلسلة تتكون من 7 ذرات كربون. ترتبط مجموعة OH بذرة الكربون الثانية عند العد من الطرف الأيمن (تأخذ الرقم 2)، وبذرة الكربون السادسة عند العد من الطرف الأيسر (تأخذ الرقم 6). وفقاً للقاعدة، نختار الترقيم الذي يعطي مجموعة OH أقل رقم ممكن. بما أن الرقم 2 أقل من الرقم 6، فإن الترقيم الصحيح يبدأ من الطرف الأيمن. اسم الألكان المقابل هو هبتان، ومجموعة OH على ذرة الكربون رقم 2، فالاسم هو هبتان-2-ول.
في المثال السفلي في الصورة، لدينا سلسلة تتكون من 9 ذرات كربون. ترتبط مجموعة OH بذرة الكربون الثالثة عند العد من الطرف الأيسر (تأخذ الرقم 3). عند العد من الطرف الأيمن، ستحصل مجموعة OH على رقم أكبر بكثير (الرقم 7). لتطبيق القاعدة، نقارن هذين الرقمين؛ بما أن الرقم 3 أقل بكثير من الرقم 7، فإن الترقيم الصحيح يبدأ بوضوح من الطرف الأيسر لإعطاء مجموعة OH أقل رقم ممكن. اسم الألكان المقابل هو نونان، ومجموعة OH على ذرة الكربون رقم 3، فالاسم هو نونان-3-ول.
ترقيم كحول حلقي: حيث نعطي ذرة كربون الزمرة رقم 1. وهنا يجب الإشارة إلى أنه إذا وجدت مجموعات بديلة فإن الترقيم يسير في الاتجاه الذي يعطي هذه المجموعات أقل أرقام.
أمثلة بسيطة
أمثلة على أسماء الكحولات بنظام الأيوباك؛ لنأخذ أمثلة بسيطة لا تحتوي على فروع أو حلقات.
التسمية المعتمدة للمركب الظاهر في الجزء السفلي من الصورة، وفقًا لنظام IUPAC الحديث، هي بيوتان-2-ول (butan-2-ol). في هذا النظام، يُوضع رقم موضع مجموعة الهيدروكسيل بين اسم السلسلة الرئيسة واللاحقة "-ول".
بينما تُستخدم تسمية 2-بيوتانول (2-butanol) على نطاق واسع في المصادر التعليمية وبعض المراجع، إلا أنها لا تتوافق تمامًا مع الإرشادات الحديثة لتسمية المركبات العضوية. لذلك، يُوصى باستخدام "بيوتان-2-ول" في السياقات العلمية والرسمية التي تتطلب الالتزام الدقيق بتوصيات الاتحاد الدولي للكيمياء البحتة والتطبيقية (IUPAC).
لاحظ عند الميثانول لم نقل "ميثان-1-ول" لأنه لا يوجد "ميثان-2-ول". وكذلك الإيثانول لانعدام "إيثان-2-ول" (انتبه لا تخلط بينه وبين إيثان-1،2-ديول).
أمثلة على تسمية الكحولات المتفرعة
أمثلة أخرى تتضمن تسمية كحولات متفرعة:
لاحظ: في المركب أسفل الصورة، قمنا بتسميته 5-ميثيل هكسان-3-ول ولم نقل 2-ميثيل هكسان-4-ول، لأننا بدأنا الترقيم من جهة (\(\ce{OH}\))؛ وهذا تماماً ما نعني به عندما نقول "أولوية الترقيم للجهة الأقرب لمجموعة الهيدروكسيل".
التسمية الشائعة للكحولات
في هذه الطريقة، تُسمى الكحولات الشائعة بصيغة 'كحول ألكيلي' (Alkyl Alcohol) [1]، حيث يُذكر اسم مجموعة الألكيل المتصلة بمجموعة الهيدروكسيل (OH) متبوعاً بكلمة 'كحول'.
تُستخدم هذه الصيغة للمجموعات الألكيلية البسيطة مثل الميثيل والإيثيل، فنقول: كحول ميثيلي (Methyl Alcohol)، و كحول إيثيلي (Ethyl Alcohol).
ولكن، تُستخدم بادئات خاصة ضمن اسم المجموعة الألكيلية للإشارة إلى هيكل معين أو نوع ذرة الكربون المتصلة بمجموعة الهيدروكسيل، وذلك للمجموعات الألكيلية الأكثر تعقيداً أو تفرعاً. أهم هذه البادئات هي:
-
أيزو (iso): تُستخدم للكحولات التي تحتوي المجموعة الألكيلية المتصلة بمجموعة الهيدروكسيل فيها على التفرع المميز $(CH_3)_2CH-$ في أحد طرفيها. هذا يعني عملياً وجود مجموعة ميثيل (CH3) متفرعة عن ذرة الكربون الثانية **عند ترقيم سلسلة الألكيل بدءاً من الطرف الذي يحمل هذا التفرع**.
ملاحظة لتجنب اللبس!
أمثلة على كحولات تستخدم بادئة "أيزو" في تسميتها الشائعة:
هذا الترقيم الخاص بتعريف "أيزو" يشير إلى هيكل مجموعة الألكيل نفسها، ويختلف غالباً عن ترقيم نظام IUPAC للكحول كمركب كامل (والذي يبدأ من الطرف الأقرب لمجموعة الهيدروكسيل).
كحول أيزو بروبيلي، كحول أيزو بيوتيلي، كحول أيزو بنتيلي (أيزو أميلي). - ثانوي (sec): تُستخدم للكحولات التي تكون فيها مجموعة الهيدروكسيل (OH) مرتبطة بذرة كربون ثانوية (أي ذرة كربون مرتبطة بذرتي كربون أخريين). مثال: كحول بيوتيلي ثانوي. تُختصر أحياناً بـ (s-) في بعض المراجع.
- ثالثي (tert): تُستخدم للكحولات التي تكون فيها مجموعة الهيدروكسيل (OH) مرتبطة بذرة كربون ثالثية (أي ذرة كربون مرتبطة بثلاث ذرات كربون أخرى). مثال: كحول بيوتيلي ثالثي. تُختصر أحياناً بـ (t-) في بعض المراجع. [9]
مثال يتضمن كحول ذو فرع عطري
انتبه: لا تخلط بين الكحولات الأروماتية والفينولات (في الفينولات تكون مجموعة الهيدروكسيل متصلة مباشرة بحلقة البنزين).
اقرأ أيضا: تفاعلات الكحولات الكيميائية
المصادر
- أسس الكيمياء العضوية. وائل ووليد
- الكيمياء العضوية. موريسون وبويد، ترجمة صالح القادري وآخرون
- نجوى. خواص الكحولات
- RSC Secondary alcohols
- BBC. Alcohols, Types of alcohols. BITESIZE, Part of Chemistry
- Polyols, repsol
- John McMurry. (2015 print number 01). Organic Chemistry, Chapter 17. United States of America. Book. P 526
- المؤسسة العامة للتعليم الفني والتدريب المهني، الإدارة العامة لتصميم وتطوير المناهج. تقنية مختبرات كيميائية، أساسيات الكيمياء العضوية، ١٤٠ كيم. المملكة العربية السعودية. ص ٧١
- Chem.libretexts. Bookshelves. Organic Chemistry, alkanes, common names






